尿石素 A:抗衰新势力,解锁昼夜节律与健康密码
02/26/2025 17:24:40
随着社会进步与衰老机制研究的深入,抗衰策略层出不穷。然而无论方法如何迭代,良好睡眠、健康饮食、合理锻炼始终是抗衰和健康管理的三大基石。科学界已将这三要素作为“再生医学”的重要辅助手段,其在延缓衰老中核心地位不言而喻。值得注意的是,睡眠障碍已成为跨越年龄层的健康难题:年轻人因社会压力、高负荷工作与不良作息导致睡眠质量低下,老年人则因疾病及药物影响面临睡眠功能退化,而慢性睡眠剥夺与昼夜节律失调在青年群体中尤为突出。在此背景下,昼夜节律调控或许能成为突破睡眠困境的关键路径。
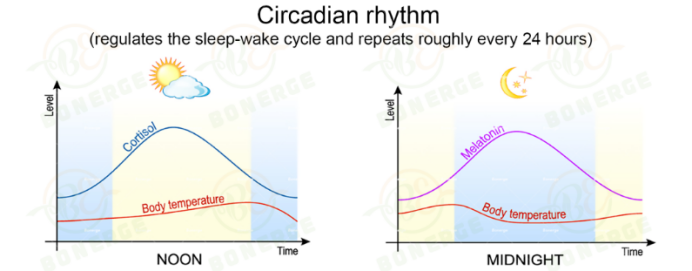
昼夜节律:健康寿命的隐形调控者
我们都知道,睡眠质量与生物钟精密关联,生物钟是生物体内调节生物节律的一种内在机制,这一内源性计时系统通过协调生理活动与外界环境周期维持机体稳态,调控生物体在不同时间进行特定的生理和行为活动。其中,昼夜节律(Circadian Rhythm)最为关键,其易受光照、进食、压力、运动及社会环境等多重因素的影响和调节。
随着年龄增长,生物钟的精准性与稳定性逐渐衰退,表现为昼夜节律基因振荡周期延长、振幅降低。研究显示,老年人普遍存在“相位前移”现象——睡眠与觉醒时间较青年人提前1-2小时,这本质上是生物钟内在机制的改变,而非单纯的行为习惯调节的结果。此外,老年人的昼夜节律振幅也会明显减弱,比如脂质昼夜节律的振幅降低约 14%。同时,褪黑素、皮质醇等昼夜节律相关激素的振幅也显著减弱,研究发现,这些节律的改变会直接增加代谢紊乱和神经退行性疾病的风险。
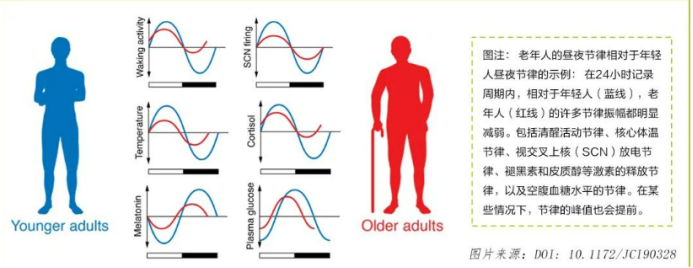
尿石素A:细胞昼夜节律的新型调控者
最新研究发现,尿石素A(Urolithin A)能够通过多维度调控细胞节律,改善睡眠质量;并对现代生活方式引发的“社会性时差”(如轮班工作、跨时区飞行、作息紊乱)等产生积极的影响,其作用机制呈现两大核心方向:
1. 调节肠道屏障昼夜节律
在一项Caco-2细胞模型的研究中,尿石素A可显著调节时钟基因(Clock Gene)的mRNA表达节律,影响其表达水平、振幅、相位峰值及曲线拟合度。在体外和体内模型中,尿石素A 均能改善由 TNF-α和 IL-17A 处理及肠道炎症引起的时钟基因和紧密连接基因的昼夜节律失调问题。
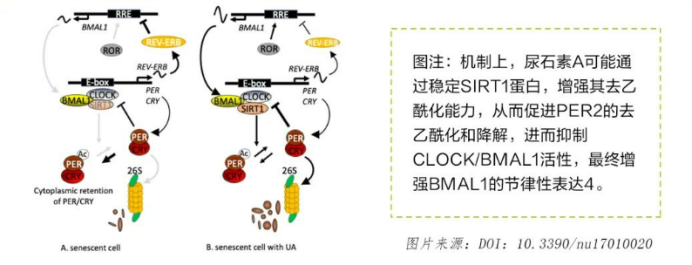
2. 增强衰老细胞节律调控
日本长崎大学的研究团队利用TIG-3细胞,探讨了鞣花酸(EA)和尿石素A(UA)对昼夜节律时钟基因表达模式的影响。研究结果显示,UA显著增强了衰老细胞中Bmal1的节律振幅(约为4倍),且这一增强效果在增殖性细胞中同样显著。这表明UA对节律时钟基因的影响可能不仅针对衰老人群,而是比预期更为广泛。【注:BMAL1(脑和肌肉芳香烃受体核转位蛋白样蛋白 1)是一种核心生物钟蛋白,与 CLOCK 蛋白形成异二聚体 CLOCK:BMAL1。这个异二聚体能够结合到许多生物钟相关基因的启动子区域,激活这些基因的转录,从而调控生物钟的节律性,使生物体的生理活动呈现出大约 24 小时的周期性,包括睡眠-觉醒周期、激素分泌周期等。】
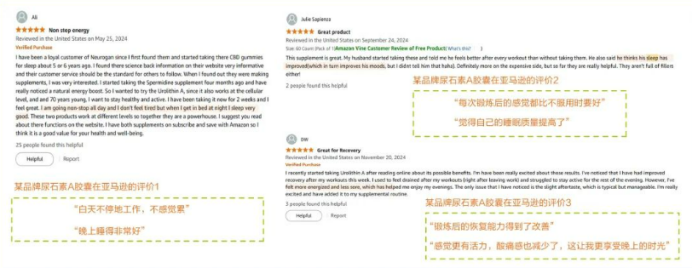
昼夜双效:日间赋能与夜间深睡的平衡艺术
基于尿石素A调节昼夜节律的机制,其在改善睡眠质量方面与直接补充褪黑素有明显不同。相较于可能引发晨起昏沉、嗜睡或眩晕的褪黑素补充剂⁶,尿石素A在提升睡眠质量的同时规避了上述副作用。据亚马逊消费者反馈显示,服用尿石素 A 后,晚上的睡眠质量和白天的精力状况都得到了明显改善。
动物实验进一步验证了这一“双效协同”机制:在睡眠剥夺小鼠模型中,尿石素A在提升细胞能量水平,以及改善睡眠不足小鼠的握力方面的效果均优于咖啡因。这可能与尿石素A 通过提高细胞 NAD + 水平、激活 Sirt1,从而维持能量稳态的机制有关8。
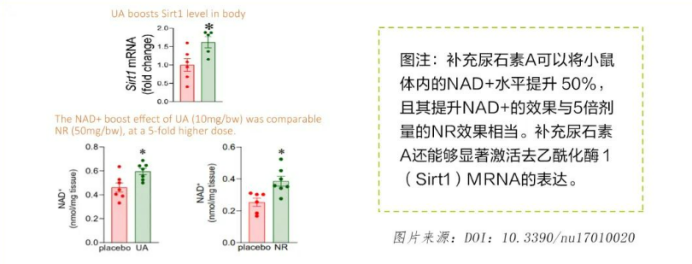
NAD+:细胞代谢的“能量货币”众所周知,NAD + 是细胞代谢和能量稳态的重要辅酶。这一关键辅酶直接参与氧化还原反应与DNA修复,是维持线粒体功能的核心因子。研究表明,补充尿石素 A 可以显著提高体内 NAD + 水平,在动物实验中,尿石素 A 能将小鼠体内 NAD + 水平有效提升50%,且其提高 NAD + 水平的能力与 5 倍剂量的 NR 效果相当。
SIRT1:代谢调控的“总开关”作为NAD+依赖性去乙酰化酶,SIRT1通过调节应激反应与代谢通路影响衰老进程。尿石素A与NMN、NR等NAD+前体类似,均通过增强SIRT1活性发挥健康效益⁹。在动物实验中,尿石素A能显著增加SIR1的表达水平。
在未来的健康管理实践中,相信尿石素A可以与饮食、运动、睡眠等传统健康基石相结合,构建更加科学、全面的健康管理体系。让我们共同期待,这一天然分子为人类健康带来的更多惊喜与突破。




